文献精读秋季班第十二讲内容提要:耐药研究套路
- 健康养生
- 1周前
- 47
上周更新的文献精读秋季班第十二讲由老谈主讲耐药研究套路。选取文献来自于(2016,IF=12.123)。中文题目为NOX4作为线粒体能量传感器耦合肿瘤代谢重编程和药物耐受。

在肿瘤治疗领域,很多肿瘤患者在接受药物治疗后会出现耐药现象。人类研究耐药机制有了几十年的历史,但是对于耐药机制的理解依旧很肤浅。
在正常细胞内,氧气充足时细胞获得能量是通过氧化磷酸化,极少数缺氧情况细胞获得能量是通过糖酵解,但肿瘤细胞都是通过糖酵解来获得能量。
这种从正常细胞到肿瘤细胞的获取能量的方式切换,被称为代谢重编程,也被认为是细胞发生癌变最重要的特征之一。
NOX4可促使产生ROS,一般认为细胞中ROS的积累会导致细胞凋亡,而作者前期研究发现在肿瘤细胞内由NOX4介导产生的ROS不仅不会导致细胞的死亡还会促进肿瘤细胞的存活。
那NOX4介导的ROS过程是如何将两大临床现象(肿瘤耐药和肿瘤细胞代谢重编程)联系起来的?这正是本文关注的内容。
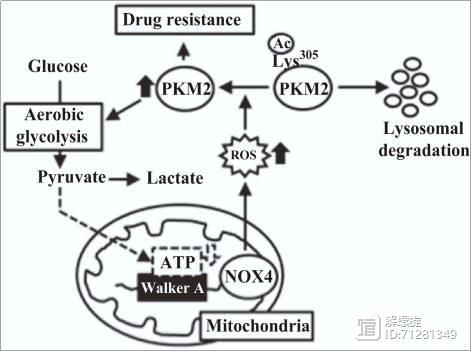
本研究发现NOX4定位于线粒体内膜中,线粒体中ATP在亚细胞水平上的重分配扮演变构开关的角色,活化NOX4。NOX4产生的ROS抑制PCAF依赖的乙酰化和PKM2的溶酶体降解。
结果总览
Fig.1-Fig.3是本文的第一部分内容,证实ATP可与NOX4结合并且一直NOX4的作用。ATP是能量代谢的重要产物,因此通过以上结果将NOX4与能量代谢建立联系。
图4则证明NOX4参与RCC肾癌的耐药现象。
图5和图6通过机制研究证实,NOX4通过调控PKM2影响RCC的耐药现象。
最后图7-图9分别在动物、临床样本、来源于临床样本的原代细胞中证实了能量代谢调控ATP,ATP调控NOX4,NOX4调控PKM2介导RCC耐药。
本研究虽然机制比较复杂,但是条理清晰,思维缜密,值得大家细细品读。
数据解构
为了研究NOX4分子的功能,首先作者对NOX家族序列进行分析,经过严密的生物信息学分析,发现在C末端有一个潜在的可能的 motif。
这个motif的位置从534-541氨基酸,该结构域是NOX4特有的,进一步分析发现七在不同物种之间也具有很好的保守性。
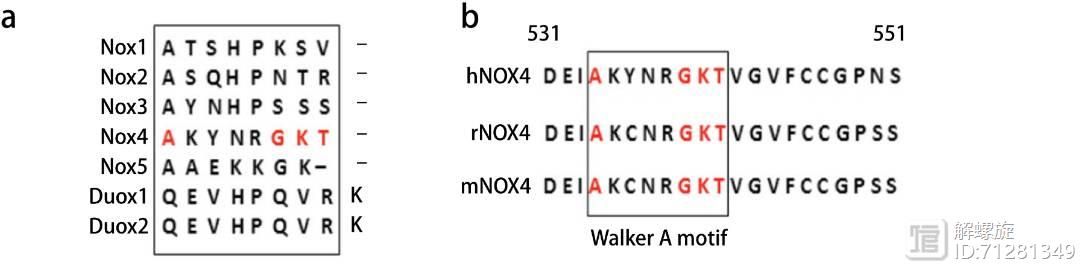
因此推测NOX4特有的结构域很可能介导了NOX4的某些特殊功能和作用,因为该NOX4特有的motif是ATP/GTP结合域。该结果也提示研究者下一步研究NOX4是否和ATP/GTP发生直接相关作用。
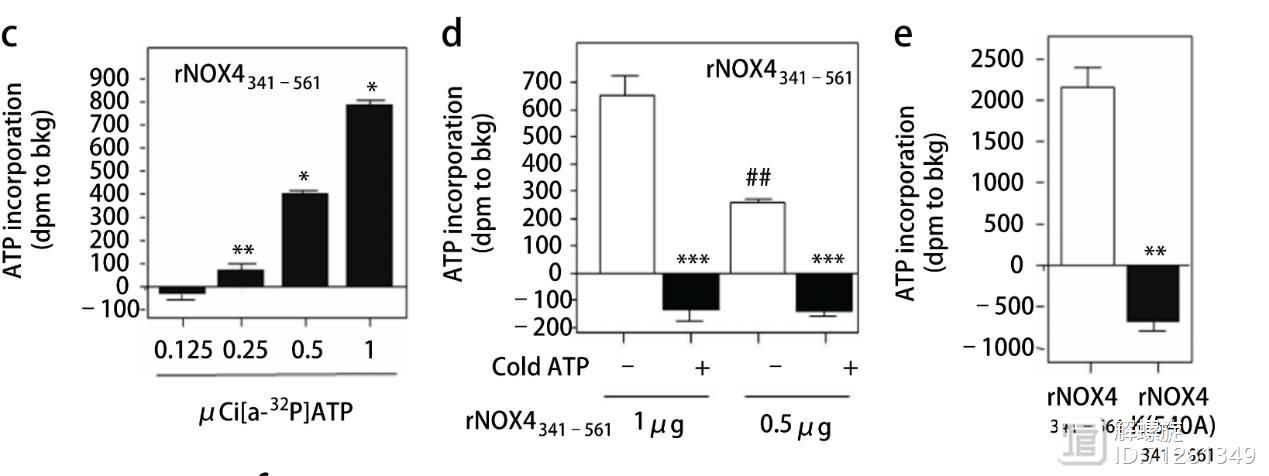
研究者克隆了NOX4的一段序列,制备NOX4突变载体后,进行NOX4与32P标记的ATP蛋白结合实验。结果证实,ATP蛋白加入剂量越大,与ATP结合的NOX4量也越大,二者呈现很好的剂量依赖关系。
在图d中是将未标记的ATP预先与NOX4充分孵育,再加入32P标记 的ATP,结果表明NOX4与未标记的ATP结合后,无法再与32P标记 的ATP结合。
图e则证实540位的赖氨酸对于NOX4与ATP结合是十分重要的,因为突变体NOX4与ATP完全没有结合。
除了体外结合实验,研究人员还采用了等离子共振技术研究ATP和NOX4的结合,将NOX4或者NOX4-MUT蛋白固定在生物芯片上,这时单个的NOX4有一个光谱,ATP和NOX4结合后,光谱发生迁移和变化。
该试验结果如下图所示,野生型的NOX4分子可以和ATP结合,光谱发生迁移和变化,而突变型的NOX4光谱变化不大。
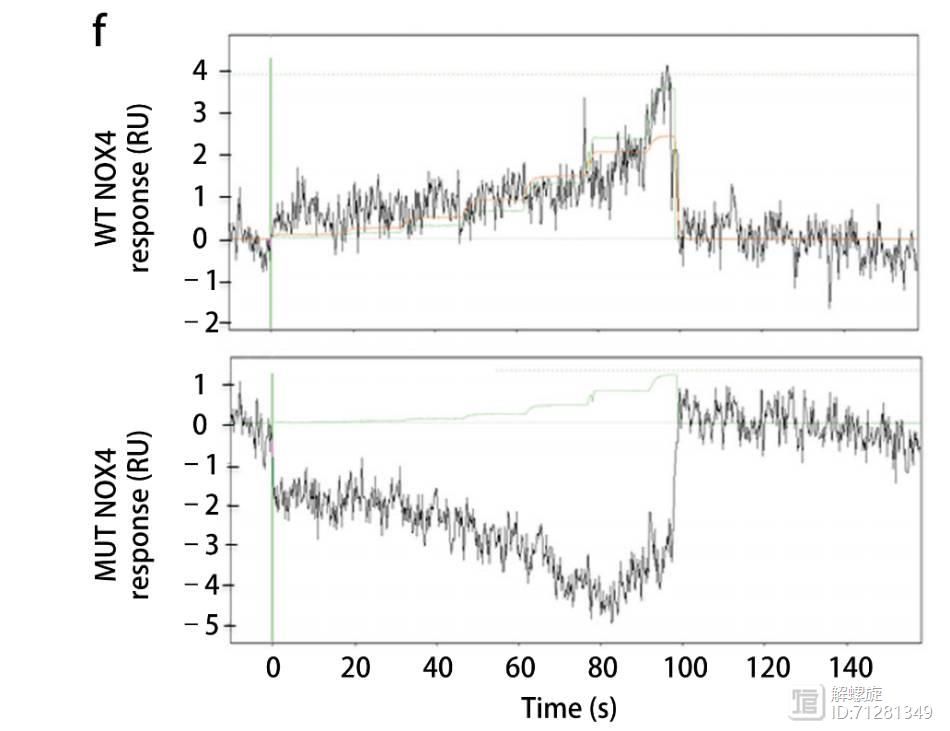
以上实验通过体外结合实验和表面等离子体共振技术都证实ATP和NOX4相互结合。那么二者结合后的生物学功能是什么呢?
为了验证这一问题,研究人员加入了生理浓度的ATP,随着加入ATP浓度升高,超氧化物的浓度越来越低。说明ATP和NOX4结合后,NOX4产生更少的超氧化物。但是如何加入ADP或者GTP则没有这种效果。
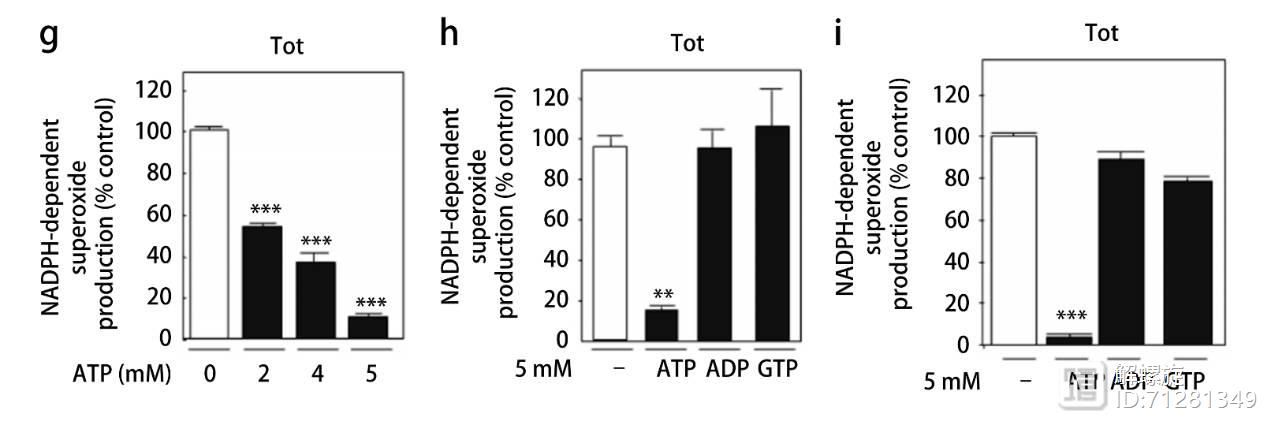
图1主要证实NOX4可与ATP相互结合,该结合作用抑制NOX4产生超氧化物的能力。
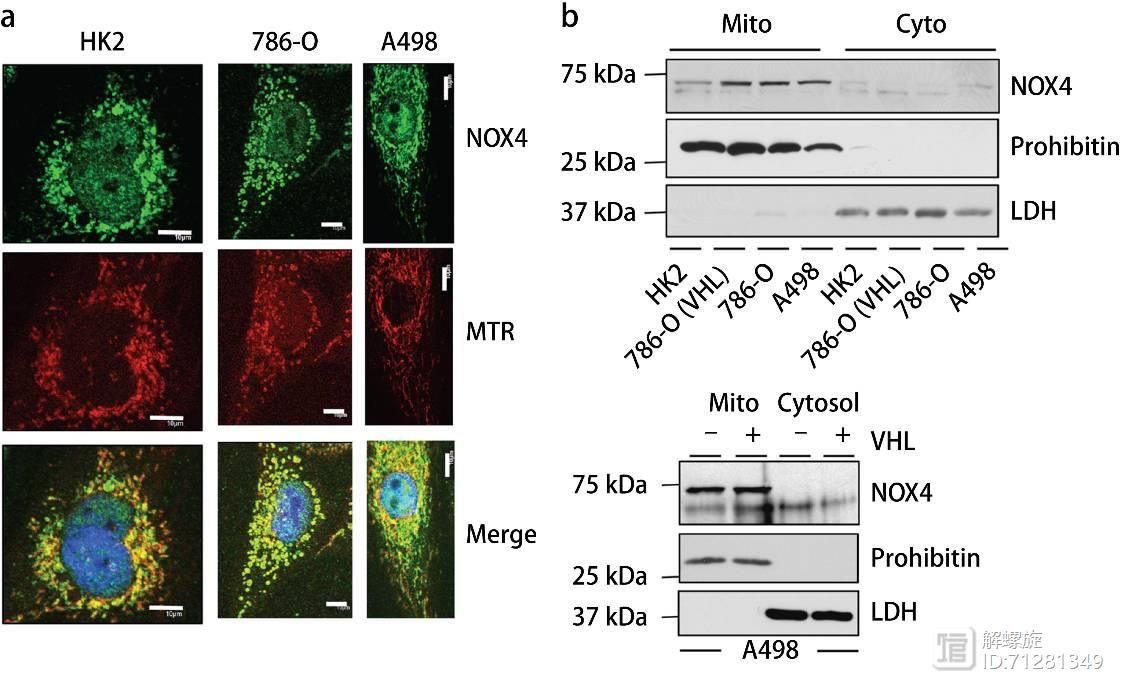
接下来主要研究NOX4的亚细胞定位,作者的前期工作中已经证实了NOX4在RCC细胞内表达上调。因此本文选用RCC细胞为研究模型,采用共聚焦显微镜检测NOX4亚细胞定位。
发现NOX4与线粒体特异性染料MTR有共定位,提示NOX4主要定位在线粒体。除此之外,作者还采用RCC进行细胞分离,分别在线粒体组分和胞浆组分中检测NOX4,发现NOX4主要定位于线粒体。
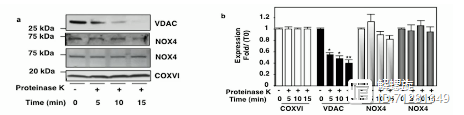
由于线粒体含有双层膜解构,那么NOX4到底定位于线粒体外膜还是内膜呢?为了回答这一问题,研究者采用了蛋白酶体外水解实验。
蛋白酶K具有光谱水解蛋白的作用,位于线粒体外膜的蛋白先被水解,内膜的蛋白后被水解。在蛋白酶处理15min后,外膜蛋白VDAC就已经被水解,但是NOX4表达没有改变,因此NOX4定位于线粒体内膜。
NOX4可促进细胞内超氧化物的产生,那么ATP和NOX4结合后,是否影响NOX4产生超氧化物的能力?首先分离线粒体,之后加入ATP,发现加入ATP后线粒体内产生超氧化物的量显著降低。
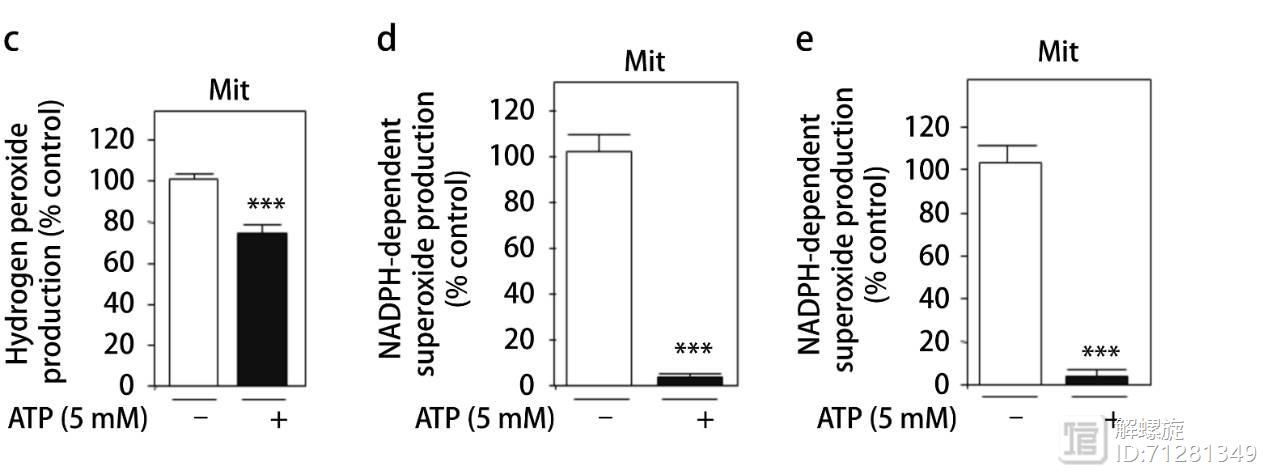
为了进一步证实ATP介导的超氧化物形成能力降低是依赖于NOX4的,研究人员在提取的线粒体样本中进行免疫共沉淀实验,富集了含有NOX4的线粒体组分,在NOX4阳性的线粒体内加入APT,超氧化物形成显著受到抑制。

图3作者主要研究NOX4与能量代谢的关系。作者研究的细胞模型是RCC,该细胞模型中缺失VHL表达,氧气的消耗速率(OCR)比较低,产生的ATP数量很少,说明细胞的氧化磷酸化速率比较低。如果在RCC模型中过表达VHL,可显著提高细胞的氧化磷酸化水平。并且提升ATP数量。
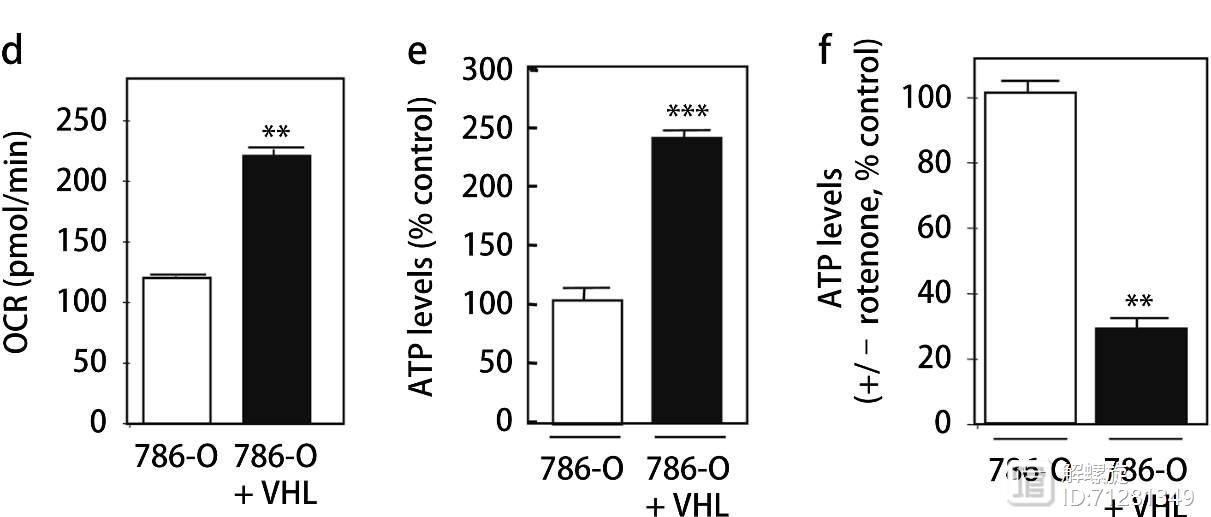
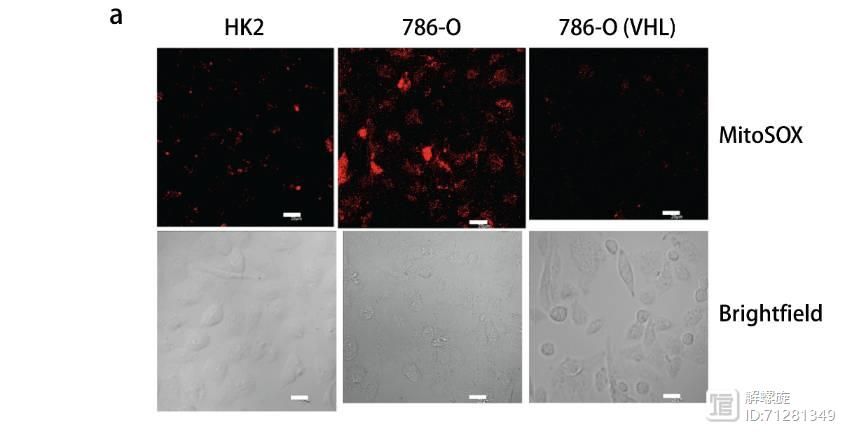
其次在缺失VHL细胞内,无论是ROS还是超氧化物或者过氧化物都显著升高。但是过表达VHL后,三者都显著升高。
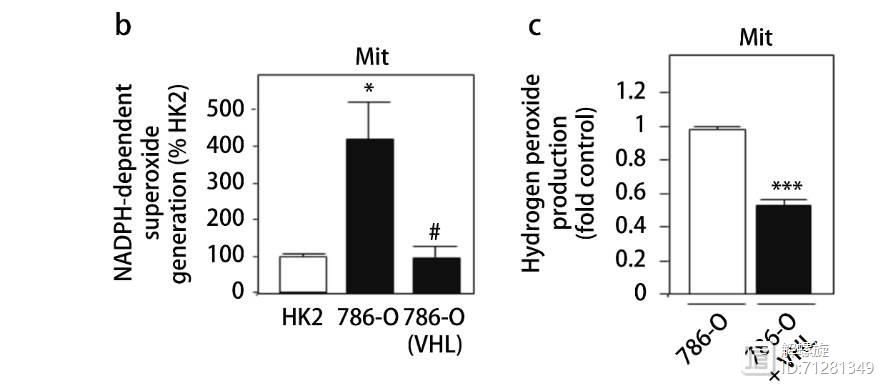
综上所述,氧化磷酸化水平升高,促进ATP产生进而抑制NOX4功能。
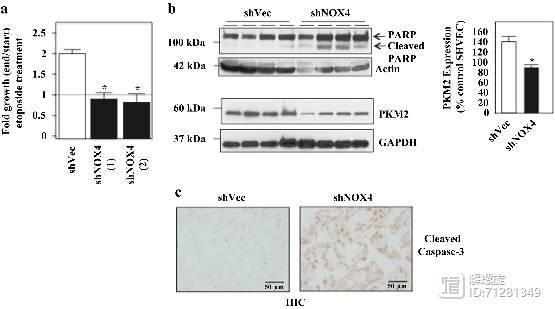
肾癌RCC细胞对药物诱导的凋亡是具有抵抗效应的。而NOX4敲减后,增强了药物诱导的凋亡现象。
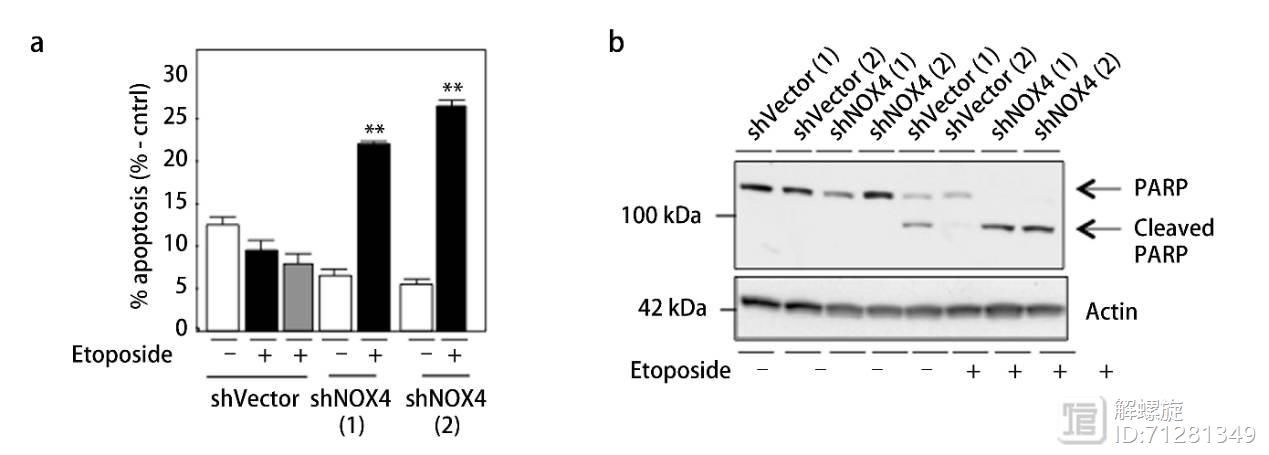
在研究体系中加入线粒体超氧化物抑制剂()中和线粒体内的超氧化物,结果细胞对药物的敏感度增加,增加凋亡比例。
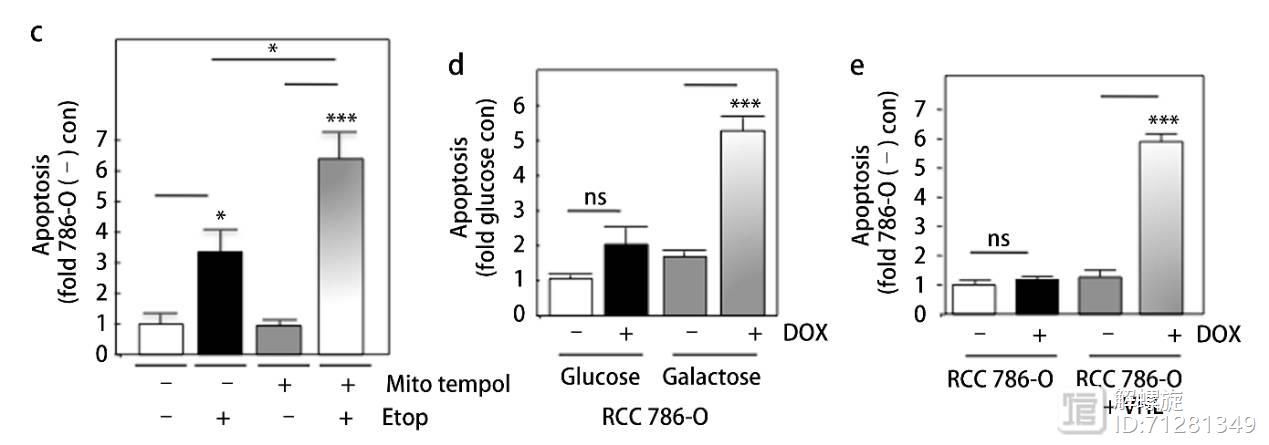
基于图2的实验结果,可推测提升ATP含量,能抑制NOX4功能,促进药物诱导的凋亡。
为了验证这一假说,研究者采用两种方式提升ATP含量,第一种加入半乳糖,另外一种是过表达VHL。实验结果显示,提高ATP后,细胞凋亡比例升高。
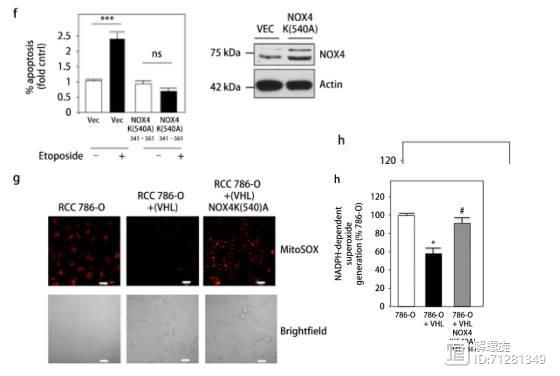
而在图f,g,h中,突变NOX4关键540位氨基酸后,以上效应消失。
图5进入机制研究,研究NOX4的下游分子。作者通过文献回顾,发现丙酮酸激酶催化糖酵解的最后一步,而且丙酮酸激酶有两种亚型PKM1、PKM2;
文献显示PKM2异常表达在肿瘤细胞内非常常见,所以作者推测PKM2可能参与了RCC细胞耐药。并且通过敲减PKM2证实了以上推测,结果见下图。
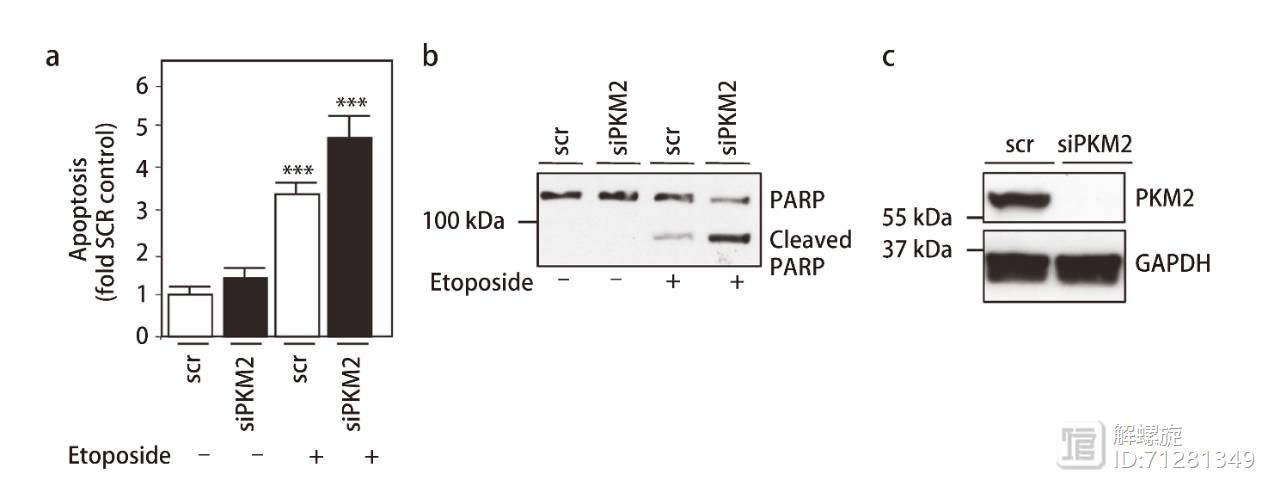
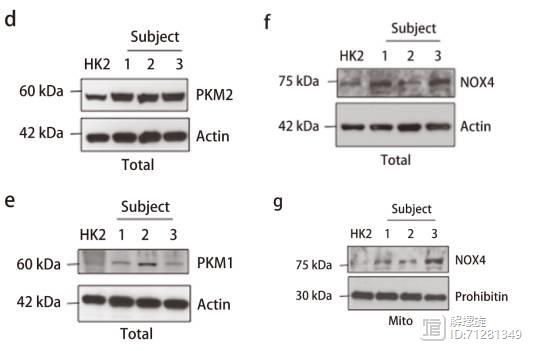
在图d和图e,作者检测敲减NOX4后,PKM2和PKM1的表达,发现PKM2表达显著降低,而PKM1表达基本不变。
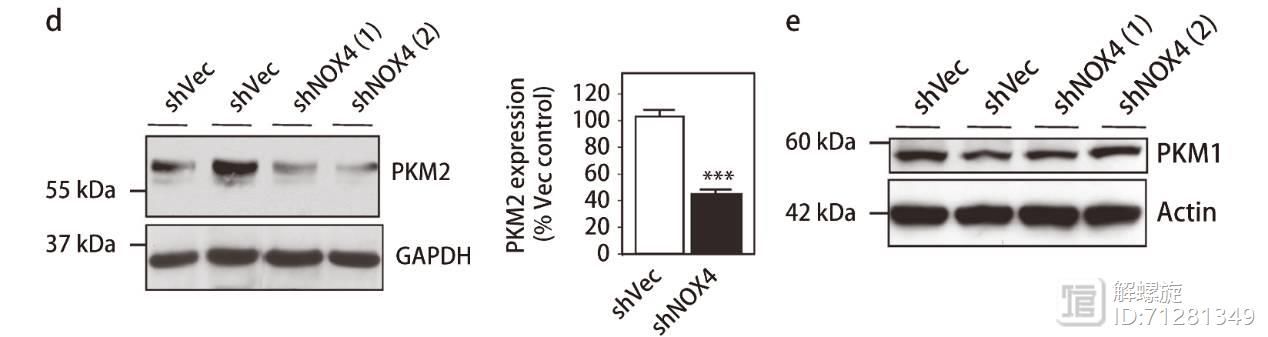
已经有文献报道PKM2可以发生乙酰化修饰,修饰后的PKM2可进入溶酶体降解途径。
因此作者在NOX4敲减的细胞内,检测PKM2乙酰化水平,发现其显著升高,初步证实NOX4敲减可提高PKM2乙酰化水平,乙酰化的PKM2进入溶酶体降解途径。
为了进一步证实该观点,加入溶酶体抑制剂3-MA后,即便敲减NOX4后,PKM2表达也不会降低。上述结果证实NOX4敲减可提高PKM2乙酰化水平,乙酰化的PKM2进入溶酶体降解途径,从而降低PKM2的表达水平。
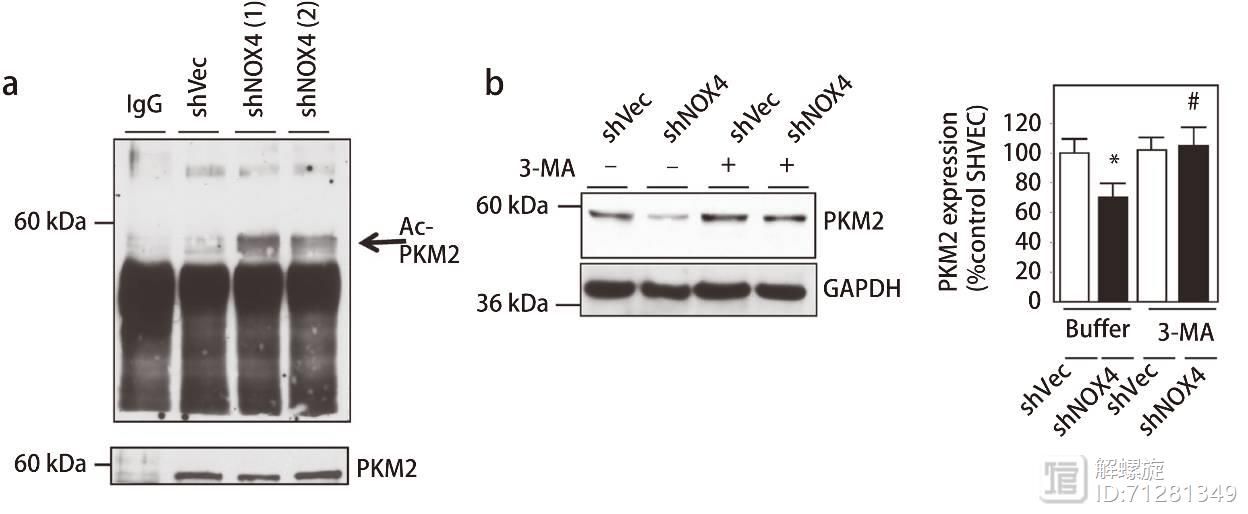
进一步研究发现,NOX4敲减的细胞内,Etop诱导的凋亡明显升高,而加入3-MA后,凋亡比例下降。
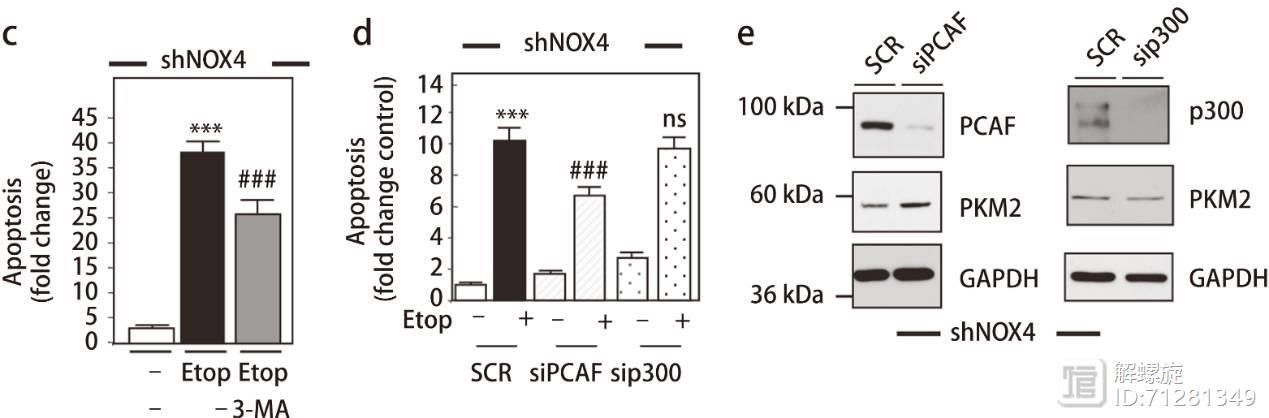
目前已经直到PCAF和P300都可以介导PKM2的乙酰化,在NOX4敲减的细胞中再敲减PCAF和P300,只有敲减PCAF细胞内凋亡比例明显下降。
实验也证实敲减PCAF细胞内,PKM2表达明显升高,而敲减PKM2后,PKM2表达不变。
随后,作者构建了一个PKM2突变的载体,并且在敲减NOX4细胞内,过表达PKM2突变质粒,药物诱导产生的细胞凋亡被抑制。
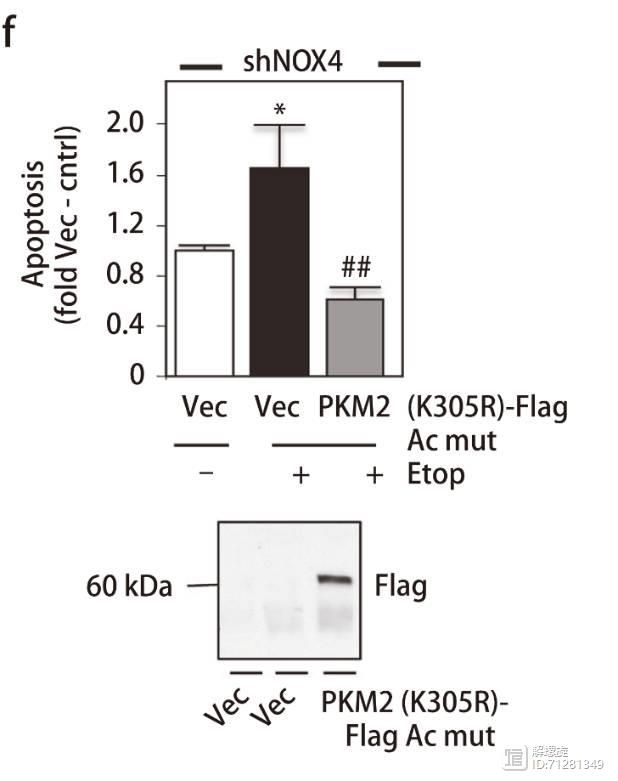
在NOX4敲减细胞内,过表达突变体NOX4K(540A),或者过表达VHl细胞中,PKM2表达量升高
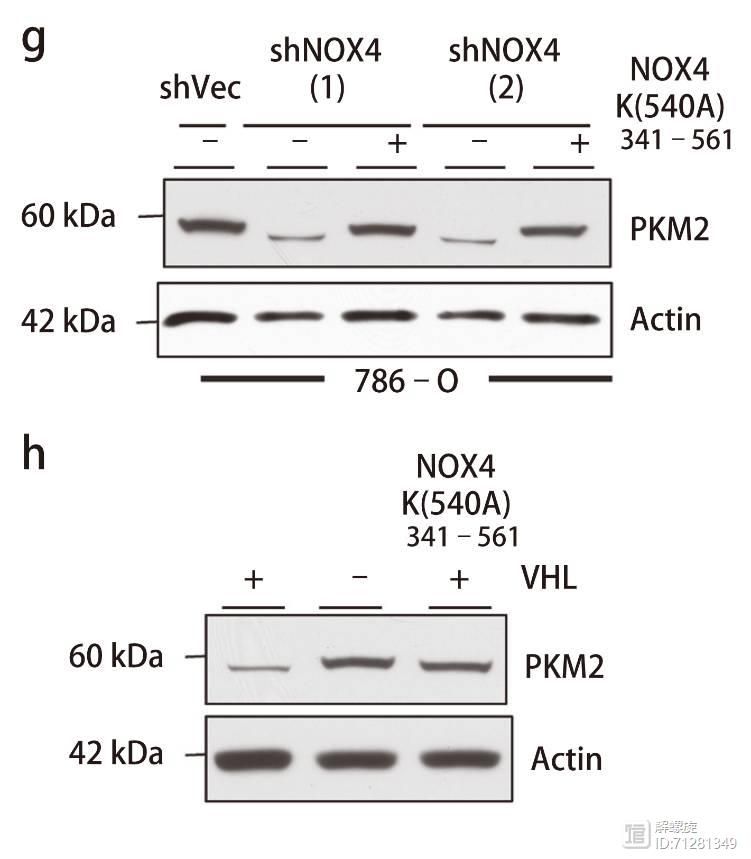
由以上结果我们可以总结出以下调控关系。

在研究完整条通路后,作者分别在动物模型和临床样本中进行了验证。
首先发现,体内实验中抑制NOX4后,RCC细胞的药物敏感性增强。
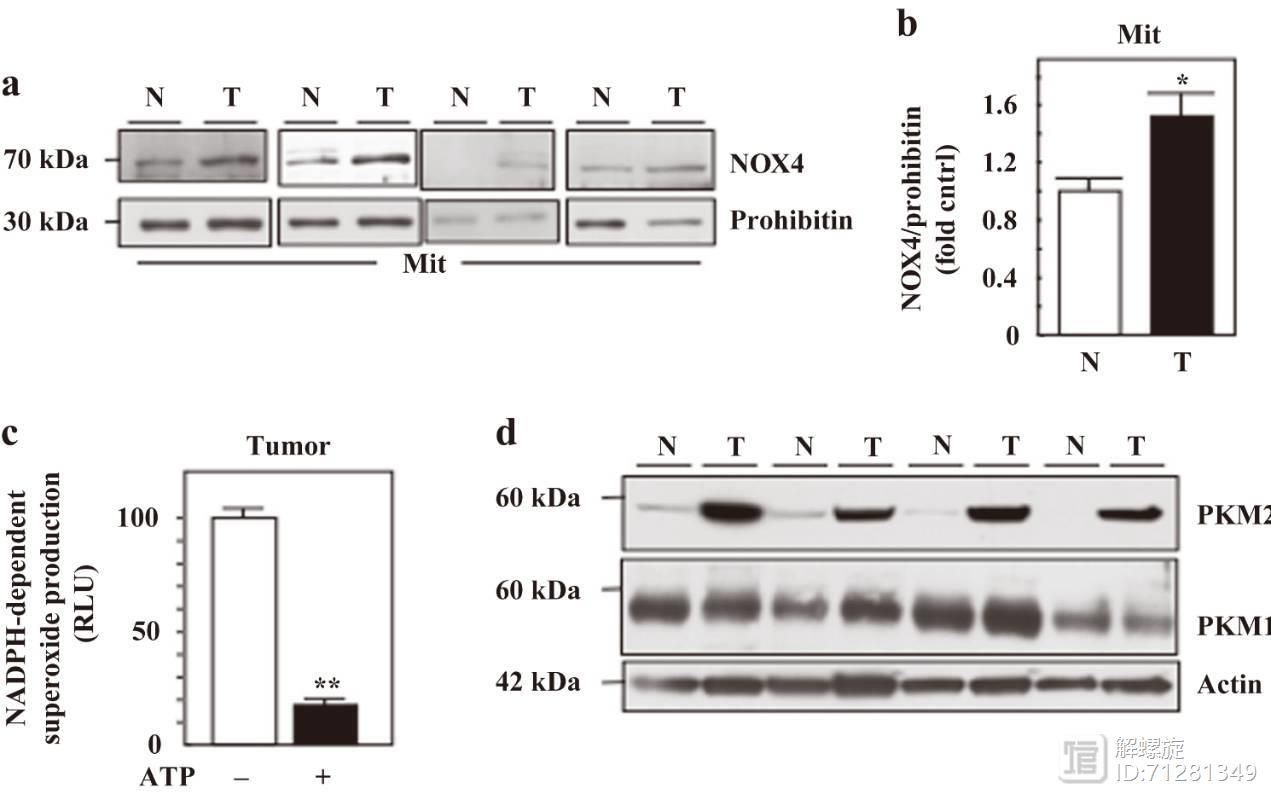
此外还在临床样本中分离了线粒体组织样本,并检测NOX4和PKM2的表达,发现二者在肿瘤来源的样本中高表达。加入ATP后,超氧化物含量显著降低。
最后为了验证NOX4是否在人的RCC内参与介导耐药。研究人员从肾癌切除术中分离RCC肾癌细胞,并在原代培养的细胞内,敲减NOX4表达加入Dox孵育,发现NOX4敲减的细胞内,DOX诱导的调往现象显著升高。
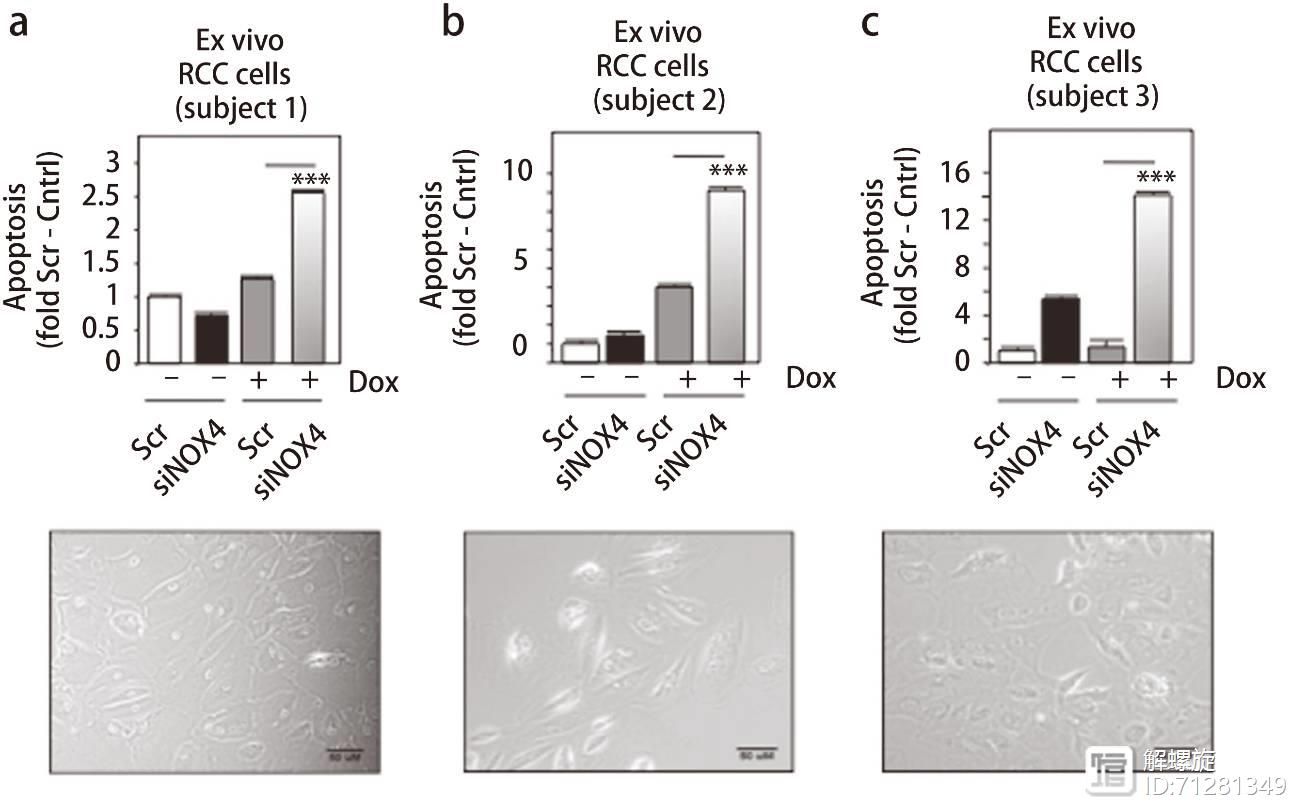
并且原代细胞内NOX4和PKM2都呈现高表达,并且PKM1表达不变。