诊断标准副肿瘤性神经综合征最新诊断标准(2021)
- 健康养生
- 12小时前
- 46

副肿瘤性神经综合征( ,PNS)是由恶性肿瘤造成其远隔部位神经系统损伤的一组综合征。PNS临床表现形式多样,诊治困难,大部分患者神经系统症状先于原发肿瘤出现,及早诊断及早治疗有利于提高患者的治疗效果。2021年,国际专家组在 杂志更新了PNS的诊断标准,为临床诊断提供了新的思路。
临床表型
研究表明,目前尚无与PNS相关的特异性神经表现,在2021版PNS诊断标准中,专家组将临床表型分为高风险表型和中风险表型。根据临床表型分型,总结如下。
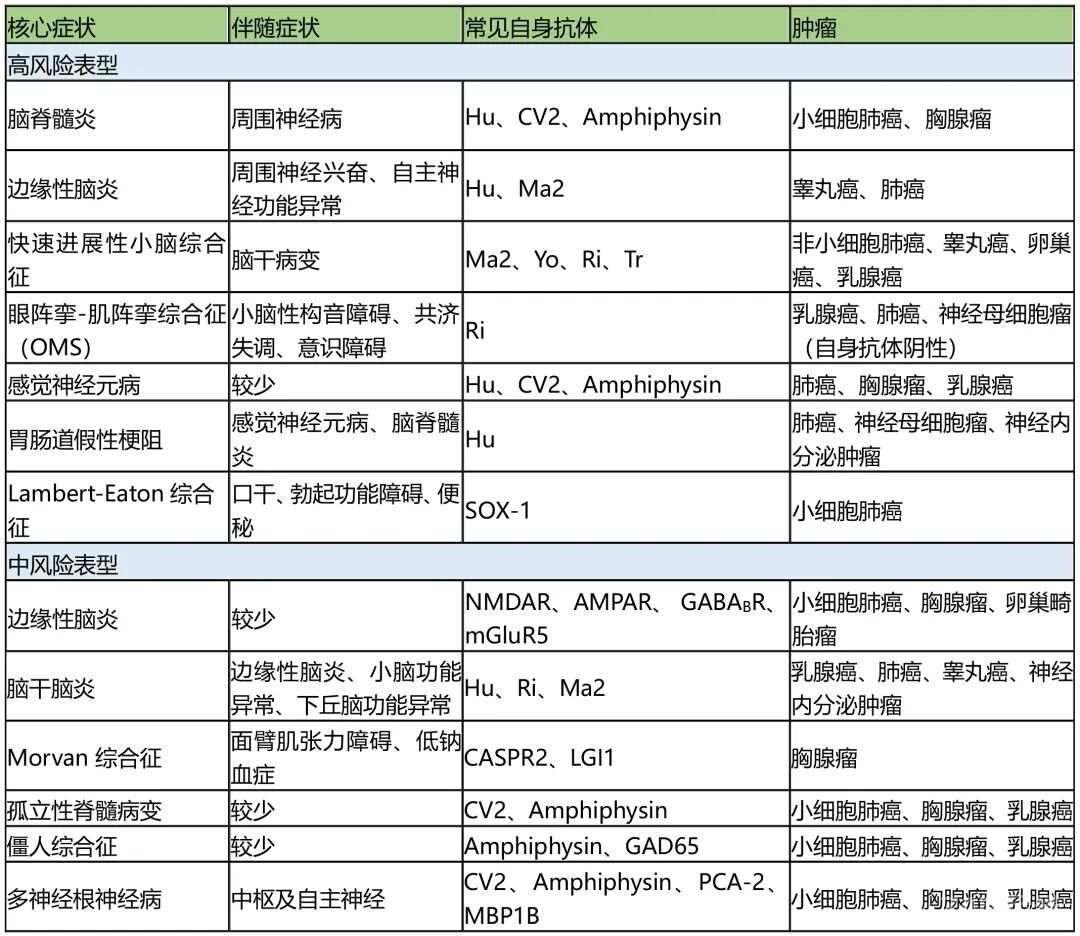
肿瘤是高风险表型重要的触发因素,常提示副肿瘤性病因,因此,可通过识别高风险表型寻找潜在的肿瘤。肿瘤搜索的范围可能取决于患者的人口统计学特征(年龄、性别)和神经元抗体的类型。
高风险表型
1.脑脊髓炎(EM)
根据2004年PNS标准的建议,脑脊髓炎仅适用于神经系统多个部位出现临床功能障碍的患者,包括周围神经系统受累。这些额外的受累区域应包括在表型描述中,例如,EM伴背根神经节炎或感觉神经元病(SNN)或EM伴周围神经病。EM与Hu抗体、CV2/CRMP5抗体阳性的小细胞肺癌(SCLC)相关。
2.边缘性脑炎(LE)
副肿瘤和非副肿瘤性边缘性脑炎患者的神经系统表现可能无法区分;一些相关抗体(和AMPAR)在50%以上的病例中可表现为副肿瘤性LE。肿瘤神经抗体,如Hu和Ma2抗体,几乎总见于成人患者,并与潜在的肿瘤有关,而表现为LE的儿童患者中检测到Hu抗体非常罕见,且常不伴有肿瘤。
3.快速进行性小脑综合征
在疾病早期多表现为不伴随小脑萎缩的急性-亚急性小脑退行性病变,患者在不到3个月内迅速发展为双侧小脑综合征,日常活动受限。步态共济失调可能是主要的或唯一的起始表现,在病程后期如出现躯干和肢体受累才能将其定义为快速进展性小脑综合征,在小脑外最常累及的部位多为脑干。孤立性小脑症状是Yo(PCA-1)和Tr(DNER)抗体的典型表现。与LE不同,新发现的副肿瘤性和非副肿瘤性快速进展性小脑综合征的抗体仅在个别病例或小样本患者中有报道。
4.眼阵挛-肌阵挛综合征(OMS)
眼阵挛-肌阵挛综合征多表现为不自主的、高频的、混乱多方向的扫视运动不伴有扫视间停顿,以及非节律性动作性肌阵挛,常累及躯干、四肢及头部。其他特征包括小脑受累(构音障碍和躯干共济失调)和脑病(从意识混乱到昏迷)。儿童副肿瘤性OMS约占病例的50%,与神经母细胞瘤密切相关,成人副肿瘤性OMS常伴小细胞肺癌(SCLC)或乳腺癌。罹患乳腺癌及副肿瘤性OMS患者多伴随Ri抗体阳性。相对于非副肿瘤性OMS成人患者,副肿瘤性OMS患者年龄更大,更多出现脑病、且预后不良。在年轻的女性患者中,OMS可与不伴随神经元抗体卵巢畸胎瘤有关。
5.感觉神经病(SNN)
由背根神经节的感觉神经元受累所致,临床表现为感觉缺损,当患者有运动功能受损及脑脊液的炎性改变时,应考虑副肿瘤因素。SNN最常见的特异性抗体是Hu抗体,其次是CV2/CRMP5和抗体。
6.胃肠道假性梗阻
胃肠道假性梗阻临床表现为反复发作的腹痛、腹胀、便秘和/或呕吐,无机械性梗阻的证据。通过胃部排空或小肠测压异常证实诊断。胃肠道假性梗阻是由肌肠神经丛功能障碍引起,可伴自主神经受累、SNN或EM等其他表现。Hu抗体的检出提示其来源为副肿瘤性。
7.-Eaton肌无力综合征
特征为进行性加重的近端肌无力,常由下肢开始,逐渐累及上肢、远端肌肉,最后为眼部和球部肌肉。约90%的患者有自主神经功能障碍的症状,包括口干、勃起功能障碍和便秘,部分患者表现为肌肉反射减退或消失,但可在重复运动或肌肉大力收缩后有所改善。P/Q型电压门控钙离子通道(VGCC)抗体可见于90%患者,可以副肿瘤和非副肿瘤形式出现。但SOX-1抗体阳性多与SCLC或跟SCLC相关的副肿瘤综合征密切相关。
中风险表型是可伴或不伴肿瘤的神经系统疾病。这些表型的出现应及时考虑PNS,特别是没有找到其他解释时,应对患者进行神经元特异性抗体检测。专家小组建议在起病后迅速进展(
中风险表型
1.边缘性脑炎
如果符合“可能的”自身免疫性脑炎的诊断标准,并检测到高或中风险抗体,则可将“确诊的”LE以外的脑炎视为中风险表型。这尤其适用于不局限于边缘系统的多灶性或弥漫性受累的病例,如抗 (代谢型谷氨酸受体5;与霍奇金淋巴瘤相关),或抗脑炎(γ氨基丁酸A受体;在成人患者中与恶性胸腺瘤相关)。对于18~35岁抗NMDAR脑炎的女性患者,常伴随卵巢畸胎瘤,出现率在35%~50%之间,大多数情况为良性。
2.脑干脑炎
脑干脑炎通常表现为眼球活动障碍和球部症状(发音困难、吞咽困难),有时伴有运动异常或小脑功能障碍,脑干脑炎常与边缘性脑炎同时存在,且与 Ma2抗体密切相关,通常伴有潜在的睾丸肿瘤或非小细胞肺癌(NSCLC)。Ma2抗体阳性患者的脑干脑炎可伴有间脑受累,其特征是白天过度嗜睡/发作性睡病、食欲亢进、体温过高和内分泌异常。球部功能障碍和中枢性低通气是Hu抗体的特征,而OMS和下颌肌张力障碍常见于Ri抗体。感音神经性耳聋常见于抗体阳性合并睾丸癌或畸胎瘤的脑干脑炎。
3.综合征
综合征的定义为周围神经过度兴奋伴脑病,其特征为行为改变、幻觉、自主神经异常和睡眠障碍,尤其是激动性失眠。综合征常与抗体及LGI1抗体相关,伴随肿瘤为恶性胸腺瘤,常出现肌无力症状。值得注意的是,LE和神经性肌强直同时出现不等同于综合征。
4.孤立性脊髓病变
孤立性脊髓病作为癌症的一种副肿瘤表现可能有不同的临床演变,在MRI研究中通常表现为纵向广泛、对称、传导束或灰质特异性异常。其主要与乳腺癌和肺癌有关,与CV2/CRMP5和抗体有关。但部分患者可能无神经元抗体,在这种情况下,当MRI提示而又没有其他诊断选择时,应考虑副肿瘤来源的可能性。
5.僵人综合征
僵人综合征(SPS)的特征是疼痛的肌肉痉挛,可以是自发的或由活动或外部感官刺激触发的。副肿瘤性SPS主要与抗体和乳腺癌有关。与非副肿瘤SPS(通常与GAD65抗体相关)相比,相关副肿瘤SPS患者年龄更大,经常累及颈部和上肢。尽管部分GAD65抗体相关的SPS患者可能合并肿瘤,但除非发现肿瘤细胞表达GAD65,否则不应考虑副肿瘤性病因。
6.多神经根神经病
副肿瘤性多发性神经根神经病典型表现为轴索病变,常伴有中枢神经系统受累。疼痛、自主神经异常和分布(对称或不对称)可变。常见自身抗体为CV2/CRMP5、、PCA-2、MBP1B,常见于SCLC或与抗体相关的乳腺癌。在癌症患者中,符合格林-巴利综合征或慢性炎症性脱髓鞘性多发性神经病诊断标准的神经病变不应被认为是副肿瘤性,除非发现了高风险抗体。
PNS相关抗体
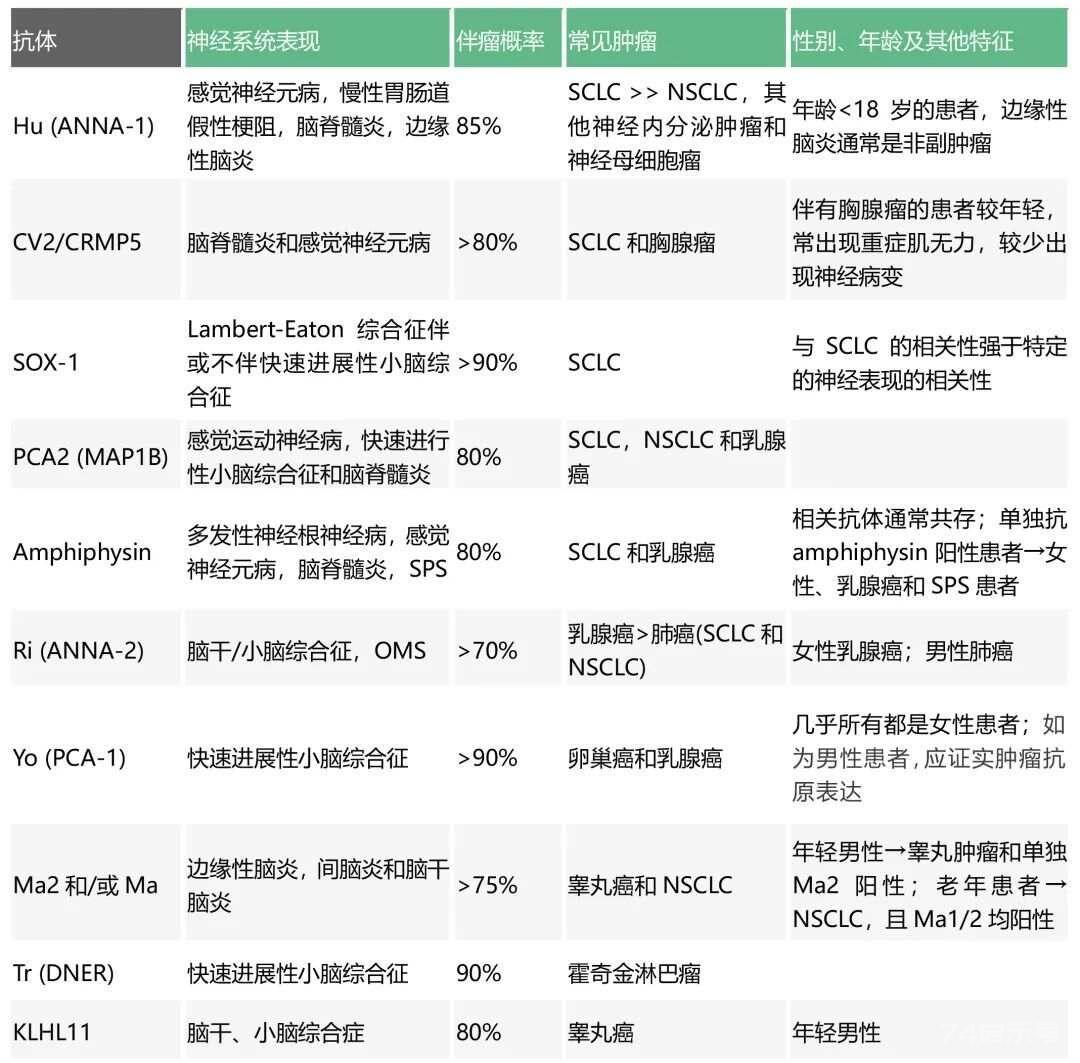
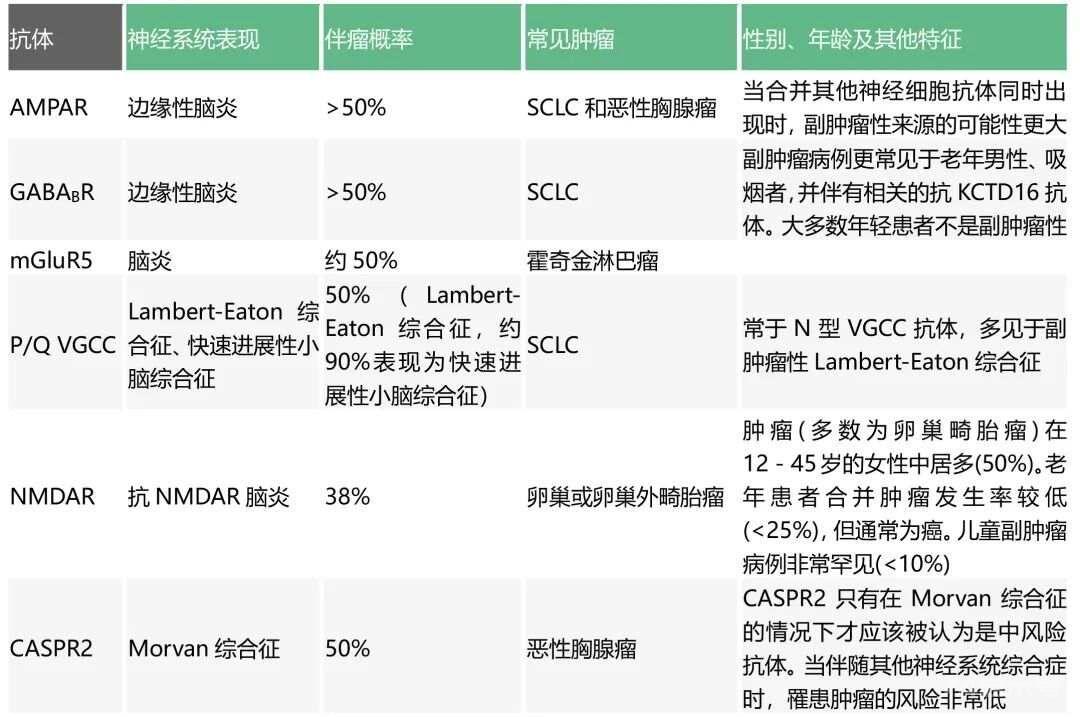
抗体对指导寻找潜在肿瘤至关重要。在PNS中,无论最终的致病作用如何,可根据与肿瘤的相关性将抗体分为高风险抗体、中风险抗体、低风险抗体,见下表。大多数高风险抗体针对细胞内抗原,目前被认为非直接致病,而仅是PNS优良的生物学标志物。中风险抗体指出现率在30%~70%的抗体。低风险抗体指出现率最低(
高风险抗体(>70%与肿瘤相关)
中风险抗体(30%-70%与肿瘤相关)
低风险抗体(<30%与肿瘤相关)
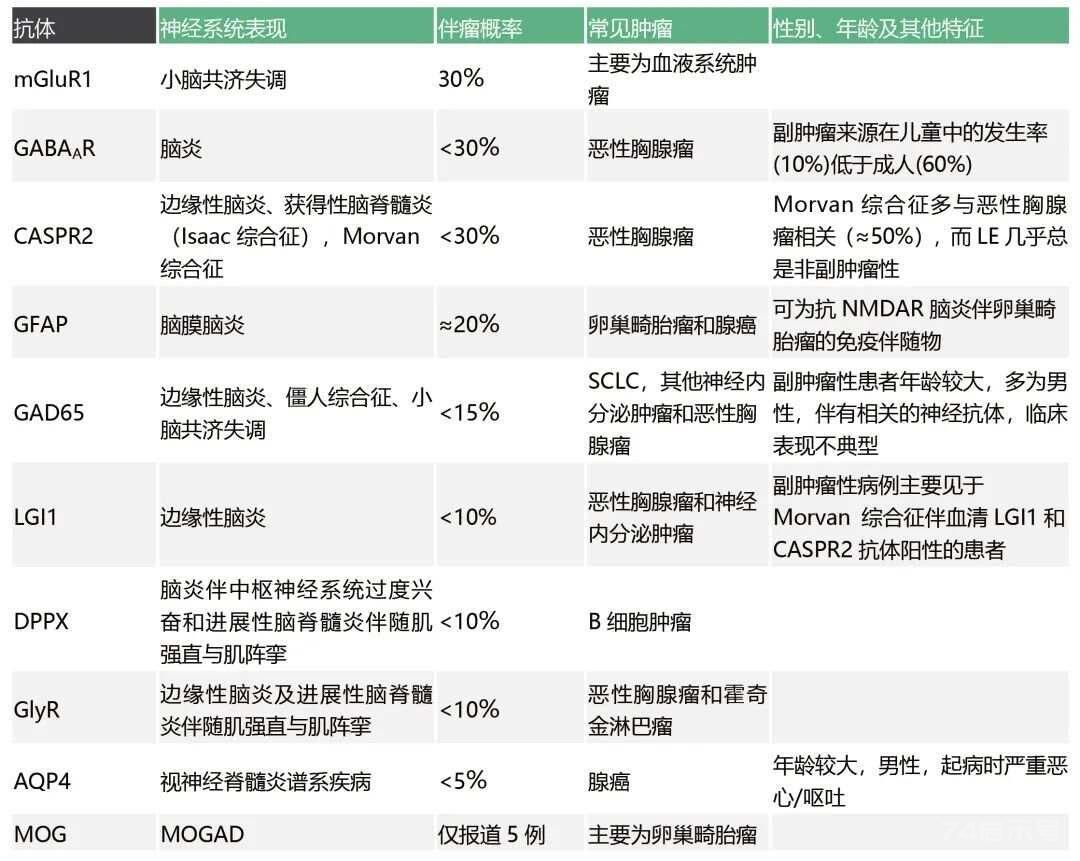
在临床实践中,与肿瘤相关的提示抗体有重要的临床意义。对于特定表型,例如边缘性脑炎,抗体的存在可提示合并肿瘤的可能性,并可指导进一步的肿瘤筛查。此外,患者可同时患有2种以上肿瘤,若发现的肿瘤与临床疑似表型或抗体类型不一致,应考虑筛查第2种肿瘤。
疑似肿瘤类型的筛查建议
SCLC和恶性胸腺瘤:胸部CT±FDG-PET/CT;对于胸腺瘤,也可行胸部MRI,尤其是在儿童患者中;
乳腺癌:乳腺钼靶成像(年轻女性和/或乳腺密度增高者可行乳腺超声[US])±乳腺MRI;若为阴性则行FDG-PET/CT;
卵巢畸胎瘤:经阴道超声检查(年轻患者可能无法操作)±盆腔/腹部MRI;如果阴性,则行胸部CT寻找盆腔外畸胎瘤;对未发现卵巢畸胎瘤的抗NMDAR脑炎患者不建议行预防性卵巢切除术;可能仅在有严重神经系统受累且经证实对一线和二线免疫疗法无反应的特定患者中考虑(考虑到对免疫疗法有反应的初步证据可能需要2-3个月),仔细权衡获益/风险比;
卵巢癌:经阴道US±腹部/盆腔MRI或FDG-PET/CT;如果阴性,经两种金标准技术证实存在抗Yo抗体且神经系统表型相符合的绝经后妇女,应考虑进行探查性手术或预防性子宫切除术和双侧输卵管卵巢切除术;
睾丸肿瘤:US±盆腔区域CT;MRI可为CT的替代选择,尤其是在儿童患者中;
霍奇金淋巴瘤:全身CT或FDG-PET/CT;
神经母细胞瘤:CT±MRI(CT通常更敏感,因为其更容易识别钙化,但MRI是胸部肿瘤分期的首选);胸部X片、腹部超声或代谢检查缺乏敏感性;
未知肿瘤:如果FDG-PET/CT阴性,则行全身CT检查;
当最初的肿瘤筛查为阴性时,对于存在高风险表型伴高风险抗体的患者,应每4-6个月复查一次,连续2年。但这仅为一般性建议,应根据危险因素、临床表型变化和医疗资源进行个体化调整。这同样适用于高风险表型伴中风险抗体的患者,此类患者常有特定的人口学特征(老年人和吸烟),或同时合并高度提示肿瘤的抗体(如-Eaton综合征中的P/Q VGCC和SOX1抗体)。
PNS相关抗体检测建议
抗体检测的金标准方法包括啮齿动物脑组织免疫化学/免疫荧光(IHC/IF),以及使用重组蛋白免疫印迹(针对大多数细胞内抗原的抗体)或基于细胞底物的分析(CBA,针对细胞表面或突触蛋白的抗体)进行检测。
01
对于神经元表面抗原的抗体,推荐同时检测血清和脑脊液样本;
02
不加区分和无重点的检测增加了假阳性和假阴性结果的可能;
03
IgG抗体具有诊断意义,IgM或IgA抗体不作为诊断性生物标志物;
04
血清阳性但脑脊液阴性的抗神经元表面抗原抗体,应在参考实验室重新评估,尤其是当患者具有高或中风险表型;
05
确保商业化免疫印迹试剂盒或CBA阳性结果经脑免疫组织化学确认;这对于仅检测了血清样本,抗体滴度低和/或结果与临床表型不一致时尤为重要;
06
严格评估与患者神经系统表型和/或肿瘤不一致的抗体阳性结果(例如,癫痫发作的男性患者伴Yo抗体阳性),并寻求另外的专业检测;
07
高度怀疑PNS但神经抗体阴性的患者,应在实验室复查血清和脑脊液样本。理想情况下,所有样本都应在经验丰富的实验室中进行检测。
PNS的诊断标准
PNS的诊断需要合理地排除其他更为常见的病因。PNS的鉴别诊断较广,包括感染、自身免疫性非副肿瘤性疾病、肿瘤、神经退行性疾病和中毒性/代谢性疾病等。综合考虑患者的临床表型、是否存在神经元抗体以及是否合并肿瘤等情况设计了评分系统(PNS-Care Score),提出了可能的、很可能的和确诊的3级PNS诊断标准,见下表。

综上,2021版PNS诊断标准主要体现下以下方面:(1)增加自2004年以来新的表型及免疫介导的机制;(2)强调原发肿瘤与副肿瘤综合征的因果关系,而非仅仅为时间上的顺序;(3)需要用金标准技术来证明神经元抗体的存在。这3个要素代表了目前PNS标准的核心。
未一医学检验实验室
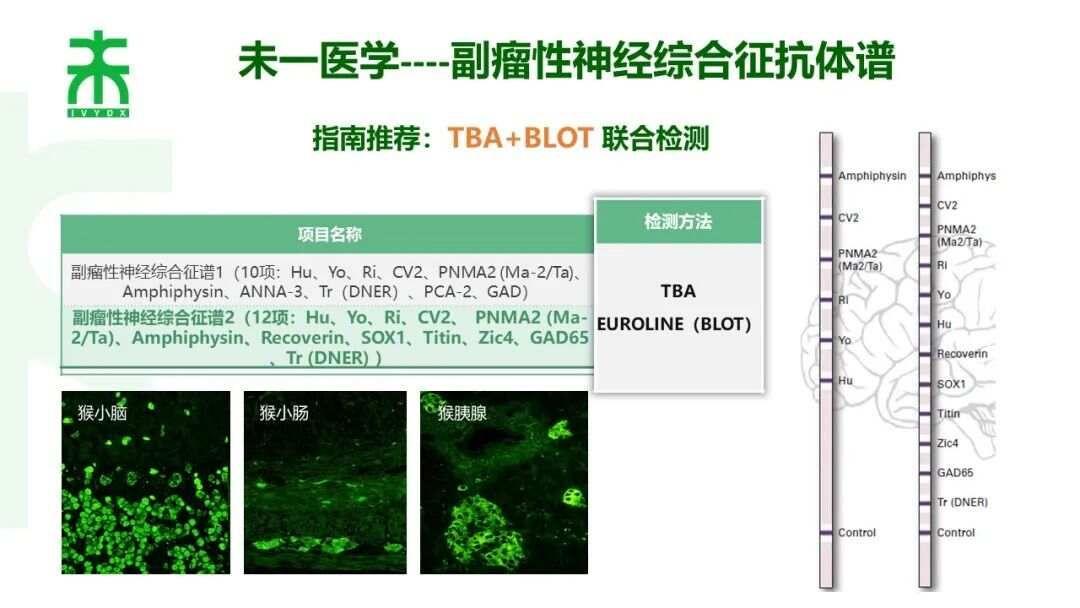
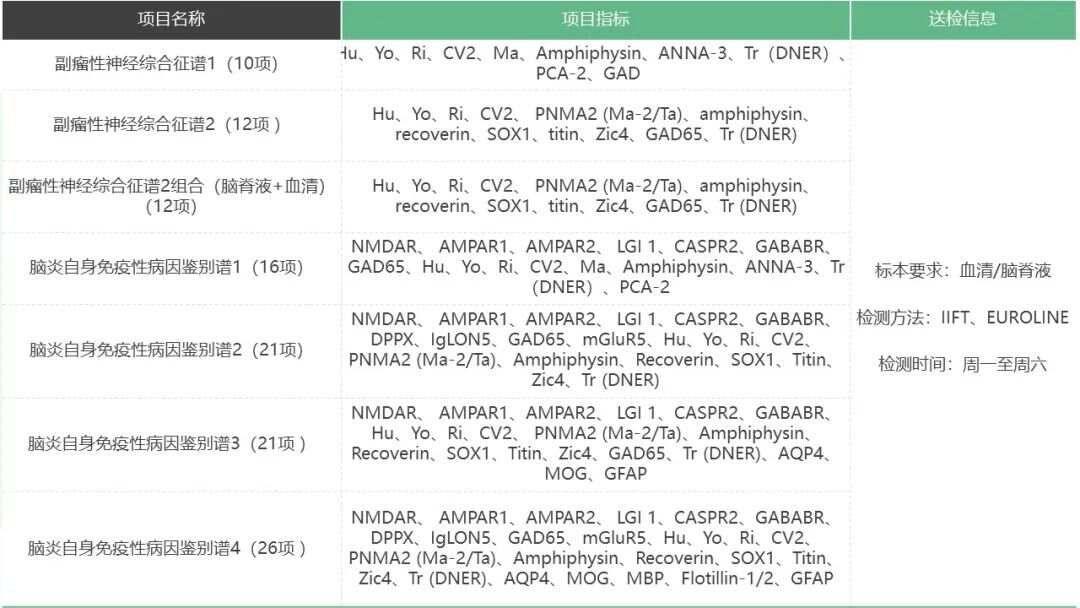
副瘤性神经综合征推荐策略
未一医学检验实验室作为国内率先常规开展TBA+CBA检测的第三方医学实验室,一直坚持TBA和多种特异性检测技术联合应用。对于副肿瘤性神经综合征抗体,未一医学采用指南推荐的TBA和免疫印迹法联合检测,两种方法检测结果互相确认,互相补充。免疫印迹法检测采用德国进口商品化试剂盒,使用创新的免疫印迹技术,将特异性的多种抗原呈条带状包被于膜基质上,每一条带对应一种抗体,不会产生非特异性反应条带,每个检测结果互不干扰,背景清晰,便于判读,结果灵敏度高,特异性好,条带显色的信号值强度与抗体滴度相关。TBA检测,采用猴小脑、猴小肠、猴胰腺多组织基质联合检测,帮助鉴别非器官特异性抗体(如抗核抗体等),同时更好地鉴别特异性荧光模式(部分抗体在脑组织中的荧光模式类似,但在其他组织中存在显著差异,如Hu和Ri),提高了对检出抗体的判读特异性,为临床诊断提供更多佐证及信息,助力精准诊疗。
TBA可提供全抗原谱,通过特异性荧光模式为发现未知的神经特异性抗体提供有力的工具。但是,不同神经抗体的荧光模式纷繁复杂且部分抗体差别细微,荧光模式的判读准确性尤为关键,决定着神经抗体评估的质量,因此,TBA实验须在判读经验丰富的实验室开展。未一医学荧光判读人员均经过系统的培训,阅读大量真实临床样本荧光片,在荧光判读方面积累了丰富的判读经验,确保报告结果准确性。
END