剖析疾病溶血过程——血管内溶血是PNH根本病因
- 健康养生
- 1周前
- 71
阵发性睡眠性血红蛋白尿症( , PNH)是一种后天获得性的造血干细胞突变所致的红细胞膜缺陷性溶血病[1]。临床主要表现为不同程度的溶血、血红蛋白尿、骨髓造血功能衰竭和血栓形成等[2]。深入研究其发病机制及溶血过程,有助于临床明确诊断及寻找合适的治疗方案。
PNH发生的根本原因是末端补体激活引起的血管内溶血
1. PNH是一种PIG-A基因体细胞突变导致的获得性造血干细胞克隆性疾病
糖化磷脂酰肌醇-A(PIG-A)基因位于X染色体上(Xp22.1),负责编码484个氨基酸的蛋白产物-1-6N-乙酰氨基葡萄糖转移酶的一个亚基。PIG-A基因在内质网膜上将UDP-N-乙酰氨基葡萄糖中N-乙酰氨基葡萄糖转移至肌醇,形成磷脂酰肌醇,这是合成糖基磷脂酰肌醇(GPI)锚连蛋白的第一步反应,因此,PIG-A基因是 GPI 锚连蛋白合成所必需的基因[3]。
然而, PNH患者由于PIG-A基因的突变,导致GPI锚连蛋白的合成在早期受阻,使得GPI无法固定在造血干细胞表面,产生了GPI锚定蛋白缺陷的前体细胞,并扩增为GPI锚定蛋白缺陷的PNH血细胞。这些血细胞表面缺失的蛋白包括CD55、CD59等[4]。其中,CD55(衰变加速因子,DAF)和CD59(反应性溶解膜抑制物,MIRL)属于补体抑制蛋白,CD55作为一种广泛表达的膜蛋白,可防止C3转化酶的形成并增加其不稳定性,从而减弱补体级联反应,而CD59是末端补体的主要抑制剂,可以抑制补体介导的裂解,并抑制膜攻击复合体(MAC)的组装。因为它们的缺失,导致不受控制的补体激活,并继而由此产生血管内溶血[5]。
2.末端补体激活介导的血管内溶血过程是PNH根本病因
补体系统是免疫系统中的重要组成部分,由一系列的血浆蛋白参与构成。补体的激活分为三种途径:经典途径、凝集素途径和旁路途径。三种途径由不同的起始因子介导并产生C3转化酶,随后,C3经由C3转化酶活化,成为C3b,并与C3转化酶结合形成C5转化酶活化C5,形成C5a和C5b, C5b与其他补体分子结合为MAC,MAC穿过PNH红细胞的脂质双分子层,在红细胞的细胞膜上形成许多小孔,水份由于渗透压作用通过孔隙进入红细胞,红细胞膨胀并最终破裂,发生溶血。因此,末端补体异常激活引起的血管内溶血是PNH的根本病因[6]。
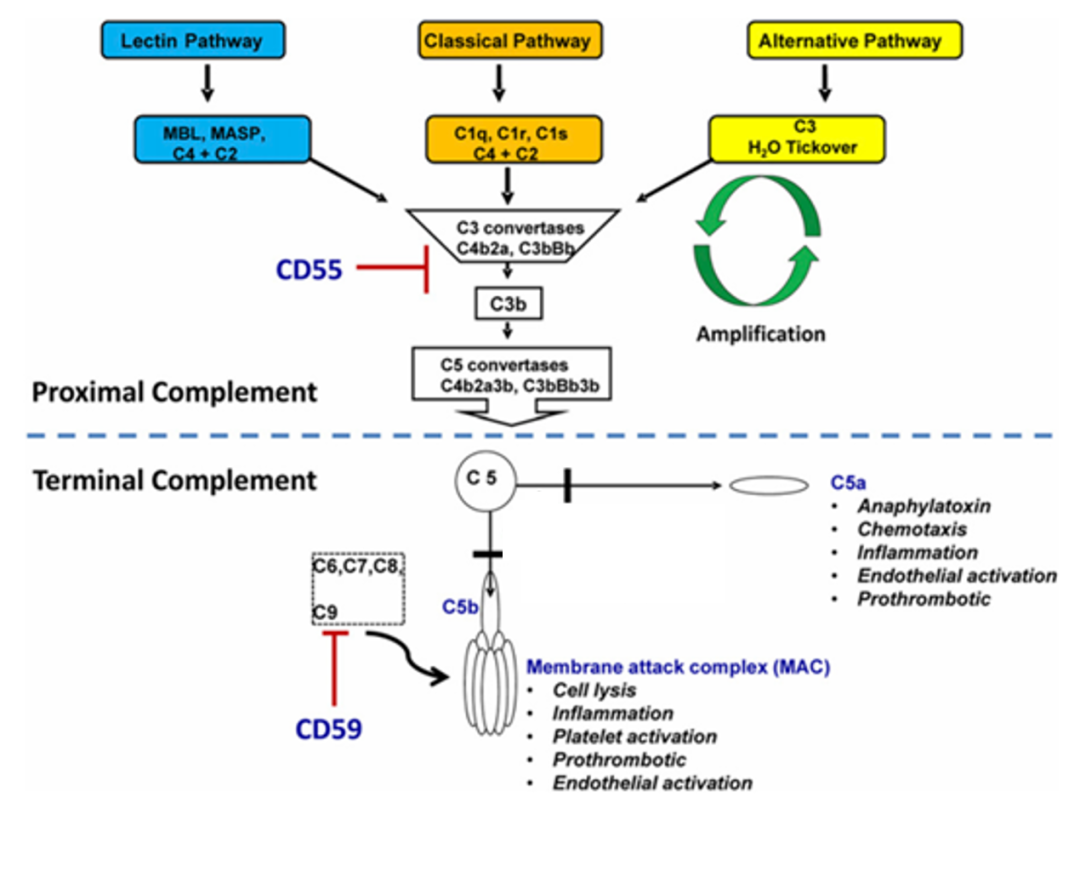
图1. 补体系统介导PNH血管内溶血过程[6]
血管内溶血与血管外溶血的区别
血管内溶血(IVH)是红细胞在血管内被破坏,当发生血管内溶血(IVH)时,红细胞直接在血循环中破裂,导致大量游离血红蛋白、血红素、铁的释放,进而引起一氧化氮的消耗,从而导致多器官损伤,可能引起血栓形成、肾功能损伤、肺动脉高压、过早死亡等严重后果[7]。
● 血栓[8-10]:这是PNH患者最常见的死因,40%至67%的PNH患者死于血栓栓塞。PNH血栓形成的机制尚不完全明确,但血管内溶血是导致凝血的重要原因,而且由于补体激活引起的溶血、炎症和凝血之间存在恶性循环,因此会不断加重血栓形成的持续进展。
●肾脏损伤[9,11,12]:肾损伤会影响约64%的PNH患者,PNH并发慢性肾脏疾病是溶血和血栓形成共同作用的结果。游离血红蛋白在肾近端小管重吸收,并在近端小管上皮细胞内分解为含铁血黄素,含铁血黄素沉积在肾脏,导致肾损伤,同时一氧化氮的的消耗、生物利用度下降会使肾脏血管收缩、阻力增大,导致肾血流量减少、肾脏缺血缺氧,造成急慢性肾损伤。
●肺动脉高压[11-13]:血管内溶血引起的一氧化氮的消耗、生物利用度下降,使肺血管平滑肌功能失调、肺血管阻力增大逐渐形成肺动脉高压,此外血液的高凝状态及肺栓塞也是肺动脉高压形成的重要原因。
PNH以血管内溶血为主,而血管内溶血的重要指标是LDH水平。LDH是人体内糖代谢中的重要激酶之一,广泛存在于人体的各种组织中,如血液、心肌、肝、肾、骨骼肌、肺等,而红细胞内的LDH约为正常血清的1000倍。一项纳入301例韩国PNH患者的回顾性注册登记研究数据显示,LDH≥1.5×ULN患者的血栓栓塞发生率,是LDH<1.5×ULN患者的7倍;如在此基础上患者还出现腹痛、呼吸困难、胸痛等症状,血栓栓塞风险还会进一步增加约10-19倍[14]。因此,PNH的主要治疗目标为降低LDH水平,而从疾病机制不难看出,补体系统在PNH的溶血发生中起到重要作用,因此对补体的抑制是治疗PNH的有效方式。
血管外溶血(EVH)是被C3b标记的红细胞在网状内皮细胞内被破坏。一般而言,血管外溶血的红细胞所受的损伤较轻,可能导致红细胞在脾、肝内被巨噬细胞识别并吞噬破坏,引起脾肿大,血清游离胆红素轻度增高等,大多数情况下的EVH并不具备显著的临床影响,无需紧急干预。
补体抑制剂是治疗PNH的有效方式
PNH的可选治疗方案包括补体抑制剂、激素、免疫抑制剂、异基因造血干细胞移植、对症支持治疗等。在补体抑制剂不可及之前,糖皮质激素、输血、铁剂、抗凝、造血干细胞移植等都是常用的治疗方案。在仅接受传统治疗下,PNH的生存和预后状况不佳,5年死亡率达到35%,10年死亡率大约50%[18]。
补体抑制剂靶向补体通路,阻断末端补体或近端补体激活,是PNH重要的治疗药物。末端补体C5抑制剂(如依库珠单抗等)可以特异性结合补体C5,阻断补体末端通路MAC的形成。补体激活的所有途径均汇聚于末端补体蛋白C5的裂解处,从而产生具有促炎和细胞裂解特性的分子。因此,补体C5抑制剂阻断末端补体激活,同时保留近端补体的免疫保护和免疫调节功能。为了最大限度地降低免疫原性,科研人员将小鼠互补决定区移植到人重链和轻链种系抗体框架序列中。此外,人 IgG2 和 IgG4 重链序列组合在一起形成杂合恒定区,该恒定区无法结合 Fc 受体或激活补体级联。依库珠单抗对人C5具有高亲和力,可有效阻断其裂解以及下游促炎和细胞溶解特性[15]。依库珠单抗研究显示治疗1周可改善PNH患者的LDH水平,到第26周LDH水平降低85.8%,输血率减少73%,生活水平也显著改善[16],降低严重血栓事件,延长生存期[17]。除依库珠单抗外,新型C5补体抑制剂如、等也已经开展了积极的临床探索。其中,在研究中显示[19],在溶血控制和避免输血的共同主要终点以及突破性溶血(BTH)和血红蛋白稳定性(Hb)的次要疗效终点中,的表现均不劣效于依库珠单抗。
末端补体C5补体抑制剂之外,又有研究者尝试探索近端补体C3、B因子、D因子抑制剂的临床应用。近端补体抑制剂通过抑制近端补体活化,阻止C3b形成C5转化酶,对上游补体通路进行阻断。其中,C3补体抑制剂在III期研究中,第16周患者血红蛋白水平(g/dl)提高2.37 g/dl,脱离输血比例达到85%[20],3年随访数据显示,仅使用,脱离输血比例下降为52%,BTH发生率为28.8%,感染发生率为78.8%[22]。B因子抑制剂在III期研究中,从基线至24周,脱离输血且血红蛋白水平增加≥2 g/dL的患者比例达92.2% [21],目前最长随访周期为48周。
总之,PNH根本病因是末端补体C5激活引起的血管内溶血,并由此带来的包括血栓、肾脏损伤、肺动脉高压在内的一系列严重危害。PNH患者的治疗目标也不仅局限于短期的疗效,更要关注患者的长期获益。
参考文献:
1.罕见病诊疗指南(2019 年版)
2.阵发性睡眠性血红蛋白尿症诊断与治疗中国专家共识[J].中华血液学杂志,2013(03):276-279.
3.阵发性睡眠性血红蛋白尿症发病机制[J].中华血液学杂志,2018,39(6):527-528.
4. AM. , 2013: 155-172.
5. V R. Clin Adv Oncol, 2013, 11(9): 1-11.
6. R P, S A, C F, et al. and of the for the of [J]. , 2007, 25(11): 1256-1264.
7.Blood (2005) 106 (11): 1046.
8.Blood (2013) 121 (25): 4985–4996.
9. da ção Médica , 2018, 64: 1139-1146.
10. of and , 2012, 10(1): 1-10.
11. of , 2015, 94(6): 464-473.
12.孙莺心,何广胜. 中国实验血液学杂志,2012,20(5):1267-1271.
13.Free and , 2012, 52(9): 1970-1986
14. R P, S A, C F, et al. and of the for the of [J]. , 2007, 25(11): 1256-1264.
15.Lee J W, Jang J H, Kim J S, et al. signs and with risk for in with from a [J]. Int J . 2013, 97: 749-757.
16. P, Young N S, J, et al. The in [J]. New of , 2006, 355(12): 1233-1243.
17. P, Muus P, Röth A, et al. Long‐term and of in with [J]. of , 2013, 162(1): 62-73.
18. P, Lewis SM, M, L, Dacie JV. of . N Engl J Med. 1995 Nov 9;333(19):1253-8.
19.Röth A, He G, A, et al. S181: THE PHASE III, 2 TRIAL: FROM A STUDY OF VS IN (PNH) NAIVE TO [J]. , 2023, 7: .
20.Peter , Jeff Szer, Ilene Weitz, et al. in .N Engl J Med 2021;384:1028-37.
21. de Ret al. Oral in . N Engl J Med. 2024 Mar 14;390(11):994-1008.
22.De , et al. Oral at: 65th ASH & ; 9-12, 2023; San Diego, CA. 574.
本材料由阿斯利康提供支持,旨在满足您的医学信息需求,仅供医疗卫生专业人士参考,不用于推广目的。
审批编号:CN-
上一篇
金融思维05金融这门生意
下一篇
虎皮鹌鹑蛋的做法








